MINI-REVUE
L'avant-poste contre le cancer : des marqueurs universels réservés au cancer
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Chine ;2 Département de chirurgie générale, premier hôpital affilié à l'Université médicale de Harbin, Harbin 150001, Chine ;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Chine ;4 Hôpital populaire de la région autonome de Ningxia Hui, Université médicale de Ningxia, Yinchuan 750002, Chine ;5Centre clinique de santé publique de Shanghai et département de chirurgie générale, hôpital Huashan, institut des métastases du cancer et laboratoire d'épigénétique de l'ARN, instituts des sciences biomédicales, faculté de médecine de Shanghai, Université de Fudan, Shanghai 200032, Chine
ABSTRAIT
Le cancer est la première cause de décès dans le monde.La détection précoce du cancer peut réduire la mortalité de tous les types de cancer ;cependant, il manque des biomarqueurs efficaces de détection précoce pour la plupart des types de cancer.La méthylation de l’ADN a toujours été une cible d’intérêt majeure, car la méthylation de l’ADN se produit généralement avant d’autres modifications génétiques détectables.En étudiant les caractéristiques communes du cancer à l’aide d’un nouveau séquençage de positionnement guide pour la méthylation de l’ADN, une série de marqueurs universels du cancer uniquement (UCOM) sont apparus comme de bons candidats pour une détection précoce efficace et précise du cancer.Bien que la valeur clinique des biomarqueurs actuels du cancer soit diminuée par une faible sensibilité et/ou une faible spécificité, les caractéristiques uniques des UCOM garantissent des résultats cliniquement significatifs.La validation du potentiel clinique des UCOM dans les cancers du poumon, du col de l'utérus, de l'endomètre et de l'urothélial soutient en outre l'application des UCOM dans plusieurs types de cancer et divers scénarios cliniques.En fait, les applications des UCOM font actuellement l’objet d’investigations actives avec une évaluation plus approfondie dans la détection précoce du cancer, le diagnostic auxiliaire, l’efficacité du traitement et la surveillance des récidives.Les mécanismes moléculaires par lesquels les UCOM détectent les cancers sont les prochains sujets importants à étudier.L'application des UCOM dans des scénarios réels nécessite également une mise en œuvre et un perfectionnement.
MOTS CLÉS
Détection du cancer ;Le dépistage du cancer;méthylation de l'ADN ;épigénétique du cancer ;biomarqueurs du cancer
Pourquoi nous avons un besoin urgent de nouveaux des biomarqueurs ?
Après plus d’un siècle de lutte contre le cancer, celui-ci reste la menace biologique la plus mortelle pour l’humanité.Le cancer reste un problème de santé mondial avec 19,3 millions de nouveaux cas et près de 10 millions de décès estimés en 20201. En 2020, on estime que 4,6 millions de nouveaux cas de cancer ont été diagnostiqués en Chine, ce qui représente 23,7 % des nouveaux cas de cancer dans le monde selon GLOBOCAN1.En outre, environ 3 millions de décès ont été attribués au cancer en Chine en 2020, soit 30 % des décès liés au cancer dans le monde1.Ces statistiques indiquent que la Chine se classe au premier rang en termes d'incidence et de taux de mortalité du cancer.De plus, le taux de survie au cancer à 5 ans est de 40,5 %, soit 1,5 fois inférieur au taux de survie à 5 ans aux États-Unis2,3.La survie comparativement plus faible et les taux de mortalité plus élevés en Chine que dans les pays ayant des indices de développement humain plus élevés suggèrent qu’un système de prévention et de surveillance du cancer efficace et rentable est nécessaire de toute urgence.La détection précoce du cancer est l’un des éléments les plus critiques d’un système de santé.La détection précoce du cancer peut améliorer le pronostic et la survie à un stade précoce dans presque tous les types de cancer4.Les stratégies de dépistage efficaces ont conduit à une baisse significative de l'incidence et des taux de mortalité des cancers du col de l'utérus, du sein, colorectal et de la prostate.
Cependant, parvenir à une détection précoce du cancer n’est pas une tâche facile.L'étude de la biologie et du pronostic du cancer précoce, l'identification et la validation de biomarqueurs de détection précoce fiables et le développement de technologies de détection précoce accessibles et précises ont toujours été les plus grands obstacles dans ce processus4.Une détection précise du cancer permet de distinguer les lésions bénignes des lésions malignes, ce qui permet d'éviter des procédures inutiles et facilite la gestion ultérieure de la maladie.Les stratégies actuelles de détection précoce comprennent les biopsies à l'aide d'endoscopes, l'imagerie médicale, la cytologie, les tests immunologiques et les tests de biomarqueurs5-7.Étant intrusives et coûteuses, les biopsies à l’aide d’endoscopes représentent un fardeau intrinsèquement lourd en tant que procédure médicale majeure faisant appel à du personnel professionnel.Comme la cytologie, les deux méthodes de dépistage dépendent des professionnels de la santé et reposent sur le jugement personnel avec des performances loin d’être idéales8.En revanche, les tests immunologiques sont très imprécis, étant donné les taux élevés de faux positifs.L’imagerie médicale, en tant que tactique de dépistage, nécessite des équipements coûteux et des techniciens spécialisés.L’imagerie médicale est donc extrêmement limitée en raison de la faible accessibilité.Pour toutes ces raisons, les biomarqueurs semblent constituer une meilleure option pour la détection précoce du cancer.
Correspondance avec : Yinshan Li et Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID : https://orcid.org/0009-0005-3340-6802 et
https://orcid.org/0000-0001-9920-1133
Reçu le 22 août 2023 ;accepté le 12 octobre 2023 ;
publié en ligne le 28 novembre 2023.
Disponible sur www.cancerbiomed.org
©2023 Biologie et médecine du cancer.Creative Commons
Licence internationale Attribution-Non Commerciale 4.0
Les biomarqueurs sont actuellement classés en protéines, marqueurs de mutation de l'ADN, marqueurs épigénétiques, anomalies chromosomiques, marqueurs d'ARN dérivés directement de tumeurs ou fragments de tumeurs obtenus indirectement à partir de fluides corporels.Les marqueurs protéiques sont les biomarqueurs les plus largement utilisés dans le dépistage et le diagnostic du cancer.Les biomarqueurs protéiques, en tant que biomarqueurs de dépistage, sont limités par la tendance à être affectés par des lésions bénignes, ce qui conduit à un surdiagnostic et à un surtraitement, comme cela a été rapporté pour l'α-fœtoprotéine et l'antigène prostatique spécifique (PSA)9,10.Les marqueurs d'ARN comprennent des modèles d'expression génétique et d'autres marqueurs d'ARN non codants. Une combinaison de marqueurs d'ARN d'expression génétique peut être détectée à l'aide d'échantillons d'urine, dont la sensibilité était loin d'être satisfaisante (60 %) pour les tumeurs primitives, et dont la détection peut être affectée par la nature facile de la dégradation de l’ARN dans l’environnement normal11.Les marqueurs génétiques et épigénétiques sont tous deux confrontés au problème de la prévalence des tumeurs et de la limitation aux types de cancer.
La méthylation de l’ADN est un candidat sérieux comme biomarqueur de détection précoce depuis qu’elle a été associée pour la première fois au cancer par Feinberg en 198312. Des aberrations de méthylation de l’ADN sont observées à tous les stades du cancer, dès le stade précancéreux.Une hyperméthylation aberrante de l’ADN a généralement lieu sur les îlots CpG dans les promoteurs de gènes pour contrecarrer les suppresseurs de tumeurs13,14.Des études ont également suggéré qu’une hyperméthylation anormale de l’ADN participe à la régulation positive des régulateurs du développement15.La vallée de la méthylation de l'ADN, qui est généralement associée aux régulateurs du développement et aux cancers hyperméthylés, pourrait faire passer le mode d'expression génique à un mode plus stable dépendant de la méthylation de l'ADN et diminuer la connexion à l'histone méthylée H3K27me3 et aux protéines polycomb associées.
Parmi le grand nombre de marqueurs de méthylation de l’ADN publiés, plusieurs ont fait leurs débuts avec succès sur le marché ;cependant, les marqueurs de méthylation de l'ADN et les panels de diagnostic actuellement commercialisés n'ont pas encore pleinement exploité le potentiel de détection précoce du cancer pour de multiples raisons18.Bien qu’ils affichent pour la plupart des performances acceptables en utilisant les informations des bases de données, ces biomarqueurs fonctionnent généralement de manière moins idéale dans le monde réel en raison du fait que les échantillons du monde réel sont souvent plus complexes et moins représentatifs que ceux sélectionnés dans les bases de données.Il a été démontré que la détection précoce de la méthylation multicancer basée sur le séquençage de nouvelle génération n’a qu’une sensibilité de 16,8 % et 40,4 % dans les cancers de stade I et II, respectivement19.Les tests de détection précoce nécessitent une plus grande stabilité et des biomarqueurs plus précis.
Découverte d’un marqueur universel du cancer uniquement (UCOM) à l’aide du séquençage de positionnement guide (GPS)
Malgré des décennies de recherche sur le cancer, aucune prévention et traitement satisfaisants n’ont été réalisés.De nouvelles méthodologies sont nécessaires pour permettre aux chercheurs d’évaluer en profondeur le cancer.Au cours des 23 dernières années, 6 caractéristiques du cancer, telles que l’évasion de l’apoptose, l’invasion tissulaire et les métastases, etc., ont été étendues à 14 en incluant des caractéristiques telles que la reprogrammation épigénétique non mutationnelle et les microbiomes polymorphes20,21.À mesure que de plus amples détails sur le cancer sont dévoilés, davantage de perspectives sont introduites dans la recherche sur le cancer.La recherche sur le cancer est progressivement entrée dans une nouvelle ère dans deux directions (communalité et individualité).Avec le développement de l’oncologie de précision ces dernières années, la recherche sur le cancer s’oriente vers une thérapie ciblée individualisée et vers l’hétérogénéité du cancer22.Ainsi, les biomarqueurs du cancer récemment identifiés se sont concentrés principalement sur des types de cancer spécifiques, tels que le cancer forcé PAX623 et le BMP3 pour le cancer colorectal24.Les performances de ces biomarqueurs spécifiques aux types de cancer varient, mais il n'est toujours pas possible pour les individus sensibles de subir un dépistage simultané de tous les cancers en raison de la limitation de l'acquisition d'échantillons biologiques et du coût élevé.L’idéal serait de pouvoir identifier un biomarqueur unique et robuste, efficace pour tous les types de cancer à un stade précoce.
Pour atteindre un tel objectif idéal, un meilleur candidat biomarqueur doit être sélectionné dans la liste des types de biomarqueurs potentiels.Parmi tous les profils génétiques et épigénétiques, les aberrations de méthylation de l’ADN sont connues pour être liées au cancer et comptent parmi les premières, sinon les premières, anomalies liées au cancer à se produire chronologiquement.L'étude de la méthylation de l'ADN a commencé très tôt, mais a été entravée par le manque de méthodes de recherche.Parmi les 28 millions de sites CpG méthylés potentiels dans le génome, un nombre gérable doit être détecté et aligné sur le génome pour mieux comprendre la tumorigenèse.Le séquençage au bisulfite du génome entier (WGBS), considéré comme la référence en matière de séquençage par méthylation de l’ADN, ne peut couvrir que 50 % du Cs dans les cellules cancéreuses en raison de la nature du traitement au bisulfite qui brise les fragments d’ADN et réduit la complexité du génome au cours du processus. la transformation de Cs-en-Ts25.D'autres méthodes, telles que les puces 450 000, ne couvrent que 1,6 % de la méthylation du génome.Basé sur 450 000 données, un panel de détection de méthylation de l’ADN a une sensibilité de 35,4 % pour 6 types de cancers de stade I26.Les limitations des types de cancer, les mauvaises performances et le bruit généré par les méthodes de détection dans le processus analytique sont devenus les plus grands obstacles pour les panels de détection pan-cancer.
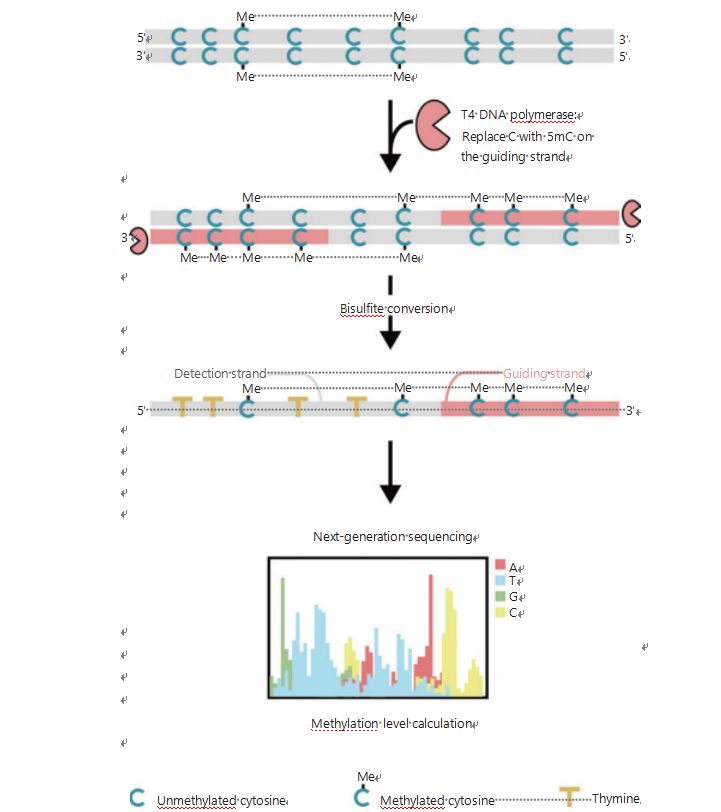
Pour mieux étudier les modèles épigénétiques des cellules au cours de la tumorigenèse et des métastases, nous avons développé un GPS unique pour la détection de la méthylation de l'ADN à l'échelle du génome, qui couvre jusqu'à 96 % des sites CpG en 0,4 milliard de lectures25.Le GPS est une méthode de séquençage bilatéral utilisant une extrémité 3 'd'un fragment d'ADN de méthyl-cytosines non convertibles après traitement au bisulfite qui guide l'alignement du calcul de la méthylation de l'ADN de l'extrémité 5' via le séquençage des extrémités de paire (Figure 1)25.Le brin directeur méthyl-cytosine, agissant comme un brin modèle, facilite l’alignement des régions à GC élevée qui récupère les données de séquençage les plus abandonnées dans le WGBS traditionnel.La fonction de couverture élevée du GPS fournit une énorme quantité d'informations sur la méthylation de l'ADN, ce qui nous permet d'examiner les profils de méthylation du cancer avec une résolution considérablement plus élevée dans des régions jusqu'alors sous-étudiées.
Le GPS nous fournit un outil puissant pour étudier l’homogénéité du cancer, ce qui peut grandement simplifier la recherche sur le cancer et potentiellement trouver une explication universelle à la tumorigenèse et aux métastases.Lors de l’analyse des données GPS des lignées de cellules cancéreuses, un phénomène unique a été fréquemment rencontré.Un certain nombre de régions semblaient anormalement hyperméthylées dans plusieurs types d’échantillons de cancer.Cette découverte inattendue a ensuite été validée pour servir d'UCOM.Plus de 7 000 échantillons provenant de 17 types de cancer dans la base de données The Cancer Genome Atlas (TCGA) ont été analysés, parmi lesquels nous avons identifié le premier UCOM, HIST1H4F, un gène lié aux histones qui est hyperméthylé dans tous les types de cancer27.Une série d'UCOM ont ensuite été trouvées et validées dans la base de données TCGA, la base de données Gene Expression Omnibus (GEO) et des échantillons cliniques du monde réel.À l'heure actuelle, HIST1H4F, PCDHGB7 et SIX6 ont été trouvés et validés en tant qu'UCOM.La découverte inattendue des UCOM offre une réponse puissante au besoin de détection précoce du cancer.Les UCOM fournissent une solution pour la détection d’un seul marqueur de plusieurs cancers.
Caractéristiques des UCOM
Après validation, il a été démontré que les UCOM présentent quatre caractéristiques majeures qui leur permettent de surpasser l'efficacité des biomarqueurs actuels (Figure 2).
Unique à la malignité
Les UCOM sont propres aux lésions cancéreuses ou précancéreuses et ne sont pas affectés par les changements physiologiques normaux.Certains des marqueurs actuels liés au cancer qui ont été largement appliqués à la détection précoce et/ou au dépistage ont conduit à un surdiagnostic.Des taux élevés de PSA, un outil de dépistage cliniquement accrédité, sont également détectés dans des affections bénignes, telles que l'hyperplasie de la prostate et la prostatite10.Le surdiagnostic et le surtraitement qui en résulte entraînent une qualité de vie réduite en raison de complications intestinales, urinaires et sexuelles28.D’autres biomarqueurs à base de protéines et largement utilisés en milieu clinique, tels que le CA-125, n’ont apporté aucun bénéfice significatif tout en entraînant un surdiagnostic et un surtraitement29.La haute spécificité des UCOM pour les tumeurs malignes évite ces inconvénients.L’UCOM, PCDHGB7, distingue efficacement les lésions épidermoïdes intraépithéliales de haut grade (HSIL) et le cancer du col de l’utérus des échantillons normaux et des lésions intraépithéliales squameuses de bas grade (LSIL), alors que la plupart des autres biomarqueurs ne peuvent différencier le cancer du col de l’utérus que des échantillons normaux30.Bien que PCDHGB7 ne détecte pas de différences significatives entre l’endomètre normal et l’hyperplasie de l’endomètre, des différences significatives sont détectées entre l’endomètre normal et l’hyperplasie atypique, et des différences encore plus importantes sont détectées entre l’endomètre normal et le cancer de l’endomètre (CE) sur la base du PCDHGB731.Les UCOM sont uniques aux lésions malignes présentes dans les bases de données et les échantillons cliniques.Du point de vue du patient, les UCOM uniques réduisent le seuil de compréhension des indications complexes de divers biomarqueurs instables peu performants et l'anxiété correspondante pendant le processus d'évaluation.Du point de vue du clinicien, les UCOM uniques différencient les tumeurs malignes des lésions bénignes, ce qui facilite le triage des patients et réduit les procédures médicales inutiles et le surtraitement.Par conséquent, des UCOM uniques réduisent la redondance du système médical, soulagent la détresse du système et mettent davantage de ressources médicales à la disposition de ceux qui en ont besoin.
Figure 1 Schéma du flux de travail GPS pour la détection de la méthylation de l'ADN25.Ligne grise : séquence d'ADN d'entrée ;ligne rouge : ADN traité avec l'ADN polymérase T4, remplaçant la cytosine par la 5′-méthylcytosine à l'extrémité 3' de l'entrée ;bleu C avec Me : cytosine méthylée ;bleu C : cytosine non méthylée ;jaune T : thymine25.
Tout ou rien
Les UCOM ne sont présents que dans les cellules cancéreuses et sont détectés de manière stable dans presque toutes les cellules cancéreuses.HIST1H4F a été validé comme étant hyperméthylé dans presque tous les types de tumeurs, mais pas dans les échantillons normaux27.De même, il a été démontré que PCDHGB7 et SIX6 sont hyperméthylés dans tous les échantillons de tumeurs, mais pas dans les échantillons normaux .Cette caractéristique unique améliore considérablement les performances des UCOM en ce qui concerne la limite de détection et la sensibilité.Seulement 2 % des cellules cancéreuses peuvent être différenciées dans les échantillons, ce qui fait des UCOM un biomarqueur beaucoup plus sensible que la plupart des biomarqueurs existants30. En tant que biomarqueur utilisé pour la détection du cancer colorectal, les mutations KRAS n'existent que dans environ 36 % des cas de cancer colorectal, suggérant un faible potentiel diagnostique33.La faible prévalence des mutations de KRAS dans le cancer colorectal limite la combinaison de KRAS avec d'autres biomarqueurs.En fait, une combinaison de biomarqueurs peut sembler prometteuse au départ, mais ne génère pas toujours un résultat satisfaisant tout en démontrant un bruit beaucoup plus important dans l'analyse de détection et implique généralement des procédures expérimentales plus compliquées.En revanche, PCDHGB7 et d’autres UCOM existent dans tous les cancers.Les UCOM détectent les composants cancéreux dans différents types d’échantillons de cancer avec la plus grande précision tout en éradiquant les processus d’analyse complexes de suppression du bruit.Il n’est pas difficile de détecter un cancer dans un échantillon abondant, mais il est extrêmement difficile de détecter un cancer dans un petit échantillon.Les UCOM sont capables de détecter de petites quantités de cancer.
Figure 2 Caractéristiques des UCOM.
Détection du cancer précédant les changements pathologiques
Les UCOM peuvent être détectés au stade précancéreux avant les changements pathologiques.En tant que biomarqueurs épigénétiques, les anomalies UCOM surviennent à un stade plus précoce que les anomalies phénotypiques et sont détectables tout au long de la tumorigenèse, de la progression et des métastases34,35.La sensibilité de l'UCOM au fil du temps améliore les performances de l'UCOM dans la détection du cancer à un stade précoce et des lésions précancéreuses.La détection d’un cancer précoce basée sur les biopsies et la cytologie peut être difficile, même pour les pathologistes les plus expérimentés.Une seule biopsie acquise par colposcopie a été rapportée comme positive dans 60,6 % des échantillons HSIL+.Des biopsies supplémentaires sont nécessaires pour les lésions multiples afin d'augmenter la sensibilité36.En revanche, l’UCOM, PCDHGB7, a une sensibilité de 82 % pour les échantillons HSIL+, dépassant la sensibilité des biopsies et de la plupart des biomarqueurs30.Le marqueur de méthylation, FAM19A4, a une sensibilité de 69 % pour CIN2+, ce qui est similaire à la cytologie, mais ne peut pas différencier CIN1 des échantillons normaux37.Il a été démontré que les UCOM sont un biomarqueur de détection précoce beaucoup plus sensible.Par rapport aux pathologistes expérimentés, les UCOM ont une sensibilité de détection supérieure pour les cancers à un stade précoce, ce qui contribue à améliorer le pronostic et la survie du cancer30.De plus, les UCOM offrent une plate-forme de détection accessible aux zones manquant de pathologistes expérimentés et améliorent considérablement l’efficacité de la détection.Grâce à des procédures d'échantillonnage et de détection uniformes, la détection UCOM produit des résultats stables et faciles à interpréter qui conviennent mieux à un protocole de dépistage nécessitant moins de personnel professionnel et de ressources médicales.
Facile à détecter
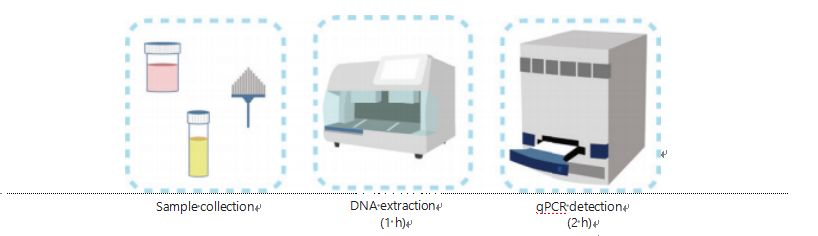
Les méthodes actuelles de détection de la méthylation de l’ADN sont compliquées et prennent du temps.La plupart des méthodes nécessitent une transformation au bisulfite, ce qui entraîne une perte de qualité de l'échantillon et produit éventuellement des résultats instables et inexacts.La mauvaise reproductibilité provoquée par le traitement au bisulfite entraîne potentiellement une confusion pour les médecins et les patients et interfère davantage avec les stratégies de suivi et/ou de traitement.Par conséquent, nous avons encore modifié la méthode de détection UCOM pour éviter le traitement problématique des échantillons au bisulfite, répondre aux exigences des applications cliniques et améliorer l’accessibilité.Nous avons développé une nouvelle méthode utilisant des enzymes de restriction sensibles à la méthylation combinées à une PCR quantitative fluorescente en temps réel (Me-qPCR) pour quantifier l'état de méthylation des UCOM en 3 heures à l'aide de procédures de manipulation simples (Figure 3).La Me-qPCR peut prendre en charge plusieurs types d’échantillons, tels que la collecte clinique de liquides corporels et les échantillons d’urine auto-collectés.Les échantillons cliniques collectés peuvent être traités, stockés et procéder facilement à la détection à l’aide d’une extraction d’ADN standardisée et automatisée.L’ADN extrait peut ensuite être directement appliqué à la plateforme Me-qPCR pour une réaction en un seul pot et des résultats de quantification.Après une simple analyse des résultats à l'aide de modèles de diagnostic adaptés et validés à des types de cancer spécifiques, la détermination finale des résultats de détection de l'UCOM est interprétée et présentée comme une valeur semi-quantitative.La plate-forme Me-qPCR surpasse le bisulfite-pyroséquençage traditionnel dans la détection UCOM tout en économisant 3 heures de conversion du bisulfite, selon le protocole du kit EZ DNA Méthylation-Gold.La plateforme innovante de détection de méthylation rend la détection UCOM plus stable, plus précise et plus accessible30.
Figure 3 Processus de détection des UCOM.Les types d’échantillons comprennent le BALF, le pinceau Pap et/ou l’urine auto-collectée échantillonnée par des professionnels.Le processus d’extraction de l’ADN peut être adapté à un extracteur automatique, dont le produit peut être directement détecté par qPCR.
Application des UCOM
Cancer du poumon
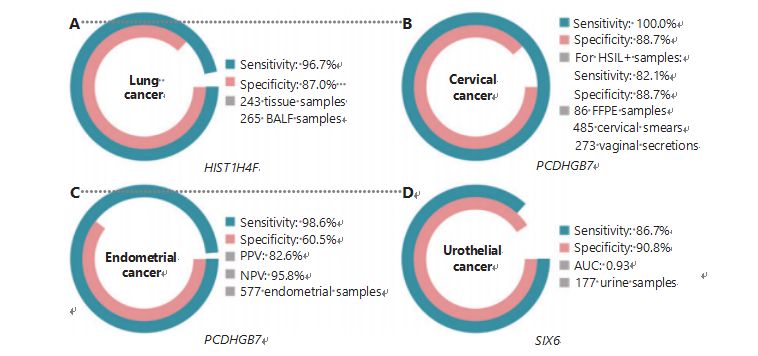
Le cancer du poumon est le deuxième cancer le plus fréquemment diagnostiqué et le plus mortel dans le monde, représentant 11,4 % des nouveaux cas et 18,0 % des nouveaux décès1.Parmi tous les diagnostics, 85 % concernent un cancer du poumon non à petites cellules (CPNPC) et 15 % un cancer du poumon à petites cellules (CPPC), qui présente un niveau de malignité plus élevé38.La tomodensitométrie à faible dose (LDCT) est la méthode de dépistage actuellement recommandée pour le cancer du poumon et il a été démontré qu'elle améliore la détection précoce et réduit la mortalité6 ;cependant, en raison de sa faible spécificité et de sa faible accessibilité, la LDCT n'est pas encore une méthode de dépistage satisfaisante, tout comme d'autres marqueurs courants du cancer, tels que le CEA39.Les coûts et les risques de diagnostics manqués et d’erreurs de diagnostic liés à la stratégie de dépistage du TPMD entravent les progrès de la promotion du dépistage du cancer du poumon40.HIST1H4F, un UCOM, présente un énorme potentiel en tant que biomarqueur de détection précoce dans les échantillons de liquide broncho-alvéolaire (BALF)27.HIST1H4F est hyperméthylé dans l’adénocarcinome du poumon et le carcinome épidermoïde du poumon, avec une spécificité de détection de 96,7 % et une sensibilité de 87,0 % (Figure 4A), et une performance exceptionnelle pour les cancers de stade I27.HIST1H4F a une spécificité de 96,5 % et une sensibilité de 85,4 % pour le CPNPC, et de 96,5 % et 95,7 %, respectivement, pour le SCLC27.De plus, des échantillons de huit autres types de cancer, notamment les cancers du pancréas et colorectal, ont confirmé que HIST1H4F est hyperméthylé dans les huit types27.
Cancer du col de l'utérus
Le cancer du col de l’utérus était le quatrième cancer le plus fréquemment diagnostiqué et la quatrième cause de décès par cancer chez les femmes en 2020, représentant 3,1 % des nouveaux cas et 3,4 % des décès liés au cancer dans le monde1.Pour éliminer le cancer du col de l’utérus d’ici 2030, comme le propose l’OMS, la détection précoce du cancer du col de l’utérus est une nécessité.S'il est détecté à un stade précoce, le taux de survie à 5 ans atteint 92 % en cas de cancer invasif du col de l'utérus41.Les lignes directrices de l’American Cancer Society (ACS) suggèrent des tests de cytologie cervicale, des tests HPV primaires ou des co-tests de dépistage42.La cytologie cervicale est invasive et ne permet de détecter que 63,5 % des cas de CIN2+37.
PCDHGB7, en revanche, a donné de bien meilleurs résultats en utilisant les tests Pap et les sécrétions vaginales, et peut différencier efficacement HSIL de LSIL à un stade ultra-précoce.PCDHGB7 seul a une sensibilité de 100,0 % et une spécificité de 88,7 % pour le cancer du col de l'utérus (Figure 4B), ainsi qu'une sensibilité de 82,1 % et une spécificité de 88,7 % pour les échantillons HSIL+30.PCDHGB7 a également une sensibilité de 90,9 % et une spécificité de 90,4 % dans les échantillons de sécrétions vaginales pour le cancer du col de l'utérus, qui sont beaucoup plus faciles à collecter30.Lorsqu'il est associé au test HPV à haut risque (hr) ou au test cytologique Thinprep (TCT), le PCDHGB7 présente une sensibilité accrue de 95,7 % et une spécificité de 96,2 %, dépassant largement celle du test hrHPV (20,3 %), TCT (51,2 % ), et les deux combinés (57,8 %) pour le cancer du col de l'utérus30.Il a également été démontré que PCDHGB7 est hyperméthylé dans 17 types de cancer de la base de données TCGA, ce qui indique son adéquation à la famille UCOM30.
Figure 4 Les UCOM ont été validées dans quatre types de cancer dans le cadre d'études cliniques à grande échelle.A. Performance de HIST1H4F, un UCOM, dans la détection du cancer du poumon sur 508 échantillons.B. Performance de PCDHGB7, un UCOM, dans la détection du cancer du col de l'utérus sur 844 échantillons.C. Performance de PCDHGB7, un UCOM, dans la détection du cancer de l'endomètre sur 577 échantillons de frottis et de brosses Tao de l'endomètre.D. Performance de SIX6, un UCOM, dans la détection du cancer urothélial sur 177 échantillons.
EC
La CE est l’un des cancers de l’appareil reproducteur féminin les plus répandus dans le monde, avec environ 4,2 millions de nouveaux cas et 1 % des décès liés au cancer chaque année1.Avec un diagnostic réussi à un stade précoce, la CE est curable et a un taux de survie à 5 ans de 95 % pour le cancer de stade I.Les patientes qui présentent des symptômes, tels qu'un saignement utérin anormal, font l'objet d'une évaluation clinique périodique et subissent des procédures de biopsie invasives et douloureuses, même si seulement 5 à 10 % d'entre elles développent éventuellement une CE43.L'échographie transvaginale, en tant que méthode de détection courante, est très peu fiable en raison de son incapacité à différencier les modifications endométriales bénignes et malignes et du taux élevé de faux positifs44.
Une comparaison parallèle du sérum CA-125, un biomarqueur EC largement utilisé, et du PCDHGB7 a été réalisée.Le sérum CA-125 avait une sensibilité de 24,8 %, ce qui suggère que le CA-125 est un marqueur inadéquat de la CE malgré une spécificité de 92,3 %31.La détection de PCDHGB7 à l’aide d’échantillons de brosse Pap a donné une sensibilité de 80,65 % et une spécificité de 82,81 % pour les stades ECatall, tandis qu’une brosse Tao avait une sensibilité de 61,29 % et une spécificité de 95,31 %31.Le modèle de diagnostic PCDHGB7, basé sur Me-qPCR, a donné une sensibilité de 98,61 %, une spécificité de 60,5 % et une précision globale de 85,5 %, en utilisant des échantillons de pinceaux Pap et Tao (Figure 4C)31.
Cancer urothélial
Le cancer urothélial, composé des cancers de la vessie, du bassinet du rein et de l'uretère, était le septième cancer le plus fréquemment diagnostiqué en 2020 dans le monde, causant 5,2 % des nouveaux cas et 3,9 % des décès1.Les cancers urothéliaux, dont plus de 50 % sont des cancers de la vessie, étaient le quatrième cancer le plus fréquemment diagnostiqué aux États-Unis en 2022, représentant 11,6 % des cas nouvellement diagnostiqués3.Environ 75 % des cancers de la vessie sont classés comme cancers de la vessie non invasifs sur le plan musculaire, limités à la muqueuse ou à la sous-muqueuse45.Une biopsie par cystoscopie est la référence en matière de diagnostic du cancer urothélial mis en œuvre par des tests d'hybridation in situ en fluorescence (FISH) et de cytologie.La FISH et la cytologie ont de mauvaises performances diagnostiques, et la cystoscopie est intrusive et présente le risque sous-jacent de manquer des microlésions, de mal interpréter les lésions et de provoquer potentiellement une propagation ou une rechute du cancer46.L'UCOM précédemment validé, PCDHGB7, s'est également révélé hyperméthylé dans le cancer urothélial, avec une aire sous la courbe de 0,86, suggérant une capacité diagnostique potentielle30.Pour valider davantage davantage d'UCOM et mieux prendre en charge davantage de types d'échantillons, SIX6, un nouvel UCOM, a été examiné et a montré un excellent potentiel diagnostique dans la détection précoce du cancer urothélial à l'aide d'échantillons d'urine sur la plateforme Me-qPCR.La détection SIX6 à l'aide d'échantillons d'urine a démontré une sensibilité compétitive de 86,7 % et une spécificité de 90,8 % (Figure 4D), tout en étant non invasive et facile à acquérir32.Le potentiel de SIX6 dans la surveillance des métastases et l’évaluation de l’efficacité du traitement est actuellement à l’étude.
L'avenir et les défis
Les UCOM ont de solides performances en termes de potentiel diagnostique de plusieurs cancers, mais il reste encore beaucoup de travail à faire.Nous avons élargi la liste des UCOM et validé activement les UCOM dans davantage de types de cancer, y compris ceux qui sont traditionnellement difficiles à détecter.Les résultats de validation des bases de données TCGA ont en outre corroboré l’application des UCOM dans davantage de types de cancer et dans davantage de situations.Lors d'une enquête préliminaire, il a été démontré que les UCOM avaient un potentiel diagnostique robuste pour les cholangiocarcinomes et les adénocarcinomes pancréatiques, qui sont presque impossibles à diagnostiquer à un stade précoce avec les méthodes de dépistage actuelles.La capacité de détecter des cancers rares avec les UCOM peut être utilisée avec l’ADN tumoral circulant (ADNct) grâce à une plateforme de biopsie liquide améliorée48.Une étude impliquant un panel de détection pan-cancer basé sur l’ADN plasmatique a donné une sensibilité de 57,9 %49.Malgré la spécificité élevée, les performances globales révèlent qu’il reste encore place à l’amélioration.
Les caractéristiques uniques des UCOM ont également soutenu l'étude du potentiel des UCOM dans l'évaluation de l'efficacité du traitement et la surveillance des récidives.Selon les critères d’évaluation de la réponse dans les tumeurs solides (RECIST), l’imagerie médicale est la méthodologie recommandée pour le suivi des récidives et l’évaluation de l’efficacité du traitement, tandis que les marqueurs tumoraux sont utilisés seuls pour l’évaluation50.En réalité, cependant, les approches d’imagerie sont fortement affectées par la fréquence et le timing, et exposent donc les patients à des risques et à des coûts plus élevés51,52.SIX6 a été validé pour servir de prédicteur des métastases du cancer du sein32.La surveillance de l'ADNc par biopsie liquide permet une surveillance en temps réel d'une maladie résiduelle minimale des mois avant la détection radiologique, retardant et prévenant idéalement la progression du cancer liée aux rechutes53.Les résultats préliminaires suggèrent que les UCOM reflètent le niveau d'hyperméthylation cancéreuse en temps réel immédiatement après la chirurgie et le traitement32.La haute sensibilité présentée par les UCOM et leur applicabilité à plusieurs types d’échantillons non intrusifs permettent aux UCOM de servir de biomarqueur précis de surveillance des récidives tout en maintenant une observance élevée du patient.
Dans le même temps, l’accessibilité du public au test constitue un autre problème majeur qui nécessite des efforts supplémentaires.Alors que des collaborations en matière de détection UCOM ont été adoptées dans davantage d'hôpitaux dans l'espoir de bénéficier à davantage de patients, des détections et des dépistages bénévoles ont été activement réalisés dans les zones rurales de Chine.Les UCOM nécessitent une accessibilité améliorée pour être considérés comme un outil de dépistage réalisable, en particulier pour les zones sous-développées.
Bien que les résultats de l’application UCOM en matière de détection précoce soient prometteurs, de nombreuses inconnues concernant UCOM existent.Avec une exploration active, des recherches supplémentaires sont justifiées sur les raisons pour lesquelles les UCOM sont universellement présentes dans les cancers.Les mécanismes de régulation épigénétique sous-jacents aux UCOM méritent des recherches plus approfondies, ce qui pourrait justifier une nouvelle orientation thérapeutique contre le cancer.Revenant à l'interaction entre l'homogénéité et l'hétérogénéité des tumeurs, nous nous intéressons à la raison pour laquelle les UCOM peuvent constituer une exception à la majorité des biomarqueurs du cancer qui sont étroitement liés à des types de cancer spécifiques.Le rôle des aberrations de méthylation de l'ADN identifiées par l'UCOM dans la tumorigenèse, la progression tumorale et les métastases n'a pas été déterminé dans le processus de perte et de récupération de l'identité cellulaire et nécessite une inspection approfondie.Un autre intérêt majeur réside dans la portée de l’incorporation du trait d’homogénéité des UCOM avec des marqueurs tissulaires uniques dans l’espoir d’approcher la détection précise des traces de cancer et l’identification des origines des tissus tumoraux de manière inverse.Les UCOM peuvent être un outil idéal pour prévenir le cancer, détecter le cancer et potentiellement défendre et éliminer le cancer.
Subvention de soutien
Ce travail a été soutenu par le programme national clé de R&D de Chine (subvention n° 2022BEG01003), la Fondation nationale des sciences naturelles de Chine (subvention n° 32270645 et 32000505), une subvention de la Commission provinciale de la santé du Heilongjiang (subvention n° 2020-111). et une subvention du Heze Science and Technology Institute (subvention n° 2021KJPT07).
Déclaration de conflit d'intérêts
Wei Li est le directeur R&D de Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu siège au conseil consultatif scientifique d'Epiprobe.W. Yu et Epiprobe ont approuvé des brevets en attente liés à ce travail.Tous les autres auteurs ne déclarent aucun intérêt concurrent.
Contributions d'auteur
Conception et conception du projet : Chengchen Qian et Wenqiang Yu.
A écrit l'article : Chengchen Qian.
Réalisation des illustrations : Chengchen Qian.
Révision et édition du manuscrit : Xiaolong Zou, Wei Li, Yinshan Li et Wenqiang Yu.
Les références
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A et al.Statistiques mondiales sur le cancer 2020 : estimations GLOBOCAN de
incidence et mortalité mondiales pour 36 cancers dans 185 pays.CA Cancer J Clin.2021 ;71 : 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S et al.Statistiques sur le cancer en Chine et aux États-Unis, 2022 : profils, tendances et déterminants.Chin MedJ (anglais).2022 ;135 : 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Statistiques sur le cancer, 2023. CA Cancer J Clin.2023 ;73 : 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M et al.Détection précoce du cancer.Science.2022 ;375 : eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Stratégies pour
dépistage du cancer colorectal.Gastro-entérologie.2020 ;158 : 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Dépistage du cancer du poumon.Am J Respir Crit Care Med.2015 ;191 : 19-33.
7. Bouvard V, Wentzensen N, Mackie A, Berkhof J, Brotherton J, Giorgi-Rossi P, et al.Le point de vue du CIRC sur le dépistage du cancer du col de l'utérus.N EnglJ Med.2021 ;385 : 1908-18.
8. Xue P, Ng MTA, QiaoY.Les défis de la colposcopie pour le dépistage du cancer du col de l'utérus dans les PRFI et les solutions par l'intelligence artificielle.BMC Med.2020 ;18 : 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Biomarqueurs circulants dans le diagnostic et la prise en charge du carcinome hépatocellulaire.Nat Rev Gastroenterol Hépatol.2022 ;19 : 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Détection précoce du cancer de la prostate basée sur le sérum PSA en Europe et dans le monde : passé, présent et futur.Nat Révérend Urol.2022 ;19 :
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et coll.Développement d'un test urinaire multiplex d'ARN pour la détection et la stratification du carcinome à cellules transitionnelles de la vessie.Clin Cancer Rés.2008 ;14 : 742-9.
12. Feinberg AP, Vogelstein B. L'hypométhylation distingue les gènes de certains cancers humains de leurs homologues normaux.Nature.1983 ;301 : 89-92.
13. Ng JM, Yu J. Hyperméthylation du promoteur des gènes suppresseurs de tumeurs en tant que biomarqueurs potentiels du cancer colorectal.IntJ Mol Sci.2015 ;16 : 2472-96.
14. Esteller M. Épigénomique du cancer : méthylomes d'ADN et cartes de modification des histones.Nat Rév Genet.2007 ;8 : 286-98.
15. Nishiyama A, Nakanishi M. Naviguer dans le paysage de la méthylation de l'ADN du cancer.Tendances Genet.2021 ;37 : 1012-27.
16. Xie W, Schultz MD, Lister R, Hou Z, Rajagopal N, Ray P et al.Analyse épigénomique de la différenciation multilignée des cellules souches embryonnaires humaines.Cellule.2013 ;153 : 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X et al.Des analyses à l'échelle du génome révèlent le rôle de Polycomb dans la promotion de l'hypométhylation des vallées de méthylation de l'ADN.Génome Biol.2018 ;19h18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et coll.Analyse de la méthylation de l'ADN dans le cancer : localisation revisitée.Nat Rev Clin Oncol.2018 ;15 : 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D et al.Validation clinique d'un test de détection précoce multi-cancer ciblé basé sur la méthylation à l'aide d'un ensemble de validation indépendant.Ann Oncol.2021 ;32 : 1167-77.
20. Hanahan D, Weinberg RA.Les caractéristiques du cancer.Cellule.2000 ;100 : 57-70.
21. Hanahan D. Caractéristiques du cancer : nouvelles dimensions.Découverte du cancer.2022 ;12 : 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Oncologie de précision : qui, comment, quoi, quand et quand pas ?Am Soc Clin Oncol Educ Livre.2017 : 160-9.
23. Liu H, Meng X, Wang J. Méthylation quantitative en temps réel
détection du gène PAX1 dans le dépistage du cancer du col de l'utérus.IntJ Gynecol Cancer.2020 ;30 : 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP et al.Tests ADN multicibles pour le dépistage du cancer colorectal.N EnglJ Med.2014 ;370 : 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S et al.Positionnement des guides
le séquençage identifie les modèles aberrants de méthylation de l’ADN qui modifient l’identité cellulaire et les réseaux de surveillance immunitaire contre les tumeurs.Génome
Rés.2019 ;29 : 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY et al.Détection multi-cancer non intrusive par séquençage de méthylation de l'ADN acellulaire circulant (THUNDER) : développement et études de validation indépendantes.Ann Oncol.2023 ;34 : 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B et al.Les gènes liés aux histones sont hyperméthylés dans le cancer du poumon et hyperméthylés
HIST1H4F pourrait servir de biomarqueur pan-cancer.Cancer Rés.2019 ;79 : 6101-12.
28. HeijnsdijkEA, Wever EM,AuvinenA, Hugosson J, Ciatto S, Nelen V et al.Effets sur la qualité de vie du dépistage des antigènes spécifiques de la prostate.N EnglJ Med.2012 ;367 : 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Efficacité clinique des tests de biomarqueurs de dépistage du cancer proposés en tant que service de santé payant : une revue systématique.Eur J Santé Publique.2016 ;26 : 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z et al.
PCDHGB7 hyperméthylé en tant que marqueur universel du cancer uniquement et son application dans le dépistage précoce du cancer du col de l'utérus.Clin Transl Med.2021 ;11 : e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X et al.PCDHGB7 hyperméthylé comme biomarqueur pour la détection précoce du cancer de l'endomètre dans les échantillons de brosses endométriales et les grattages cervicaux.Avant Mol Biosci.2022 ;8 : 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F et al.Mutuellement
modification épigénétique exclusive sur SIX6 avec hyperméthylation pour le traçage des stades précancéreux et de l'émergence de métastases.Cible de transduction de signal Ther.2022 ;7 : 208.
33. Huang L, Guo Z, Wang F, Fu L. Mutation KRAS : de non médicamentable à médicamentable dans le cancer.Cible de transduction de signal Ther.2021 ;6 : 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE et al.La méthylation aberrante de p16 (INK4a) est un événement précoce dans le cancer du poumon et un biomarqueur potentiel pour un diagnostic précoce.Proc Natl Acad Sci U SA.1998 ;95 : 11891-6.
35. Robertson, K.D..Méthylation de l'ADN et maladies humaines.Nat Rév Genet.2005 ;6 : 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Biopsies multiples et détection des précurseurs du cancer du col de l'utérus à la colposcopie.J Clin Oncol.2015 ;33 : 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD et coll.Analyse de méthylation du FAM19A4
Le gène présent dans les éraflures cervicales est très efficace pour détecter
carcinomes et lésions CIN2/3 avancées.Cancer Prev Res (Phila).2014 ;7 : 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Cancer du poumon.Lancette.2021 ;398 : 535-54.
39. Grunnet M, Sorensen JB.Antigène carcinoembryonnaire (CEA) comme marqueur tumoral dans le cancer du poumon.Cancer du poumon.2012 ;76 : 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L et al.Dépistage du cancer du poumon, version 3.2018, lignes directrices de pratique clinique du NCCN en oncologie.J Natl Compr Canc Netw.2018 ;16 : 412-41.
41. Société américaine du cancer.Faits et chiffres sur le cancer.Atlanta, Géorgie, États-Unis : Société américaine du cancer ;2023 [mis à jour le 1er mars 2023 ;cité le 22 août 2023].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et al.Dépistage du cancer du col de l'utérus chez les personnes à risque moyen : mise à jour des lignes directrices 2020 de l'American Cancer Society.CA Cancer J Clin.2020 ;70 : 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Association du risque de cancer de l'endomètre avec les saignements postménopausiques chez les femmes : une revue systématique et une méta-analyse.JAMA Stagiaire Méd.2018 ;178 : 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et coll.Sensibilité du dépistage échographique transvaginal
pour le cancer de l'endomètre chez les femmes ménopausées : une étude cas-témoins au sein de la cohorte UKCTOCS.Lancette Oncol.2011 ;12 : 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.Lignes directrices de l'Association européenne d'urologie sur le cancer de la vessie non invasif sur le plan musculaire (TaT1 et carcinome in situ) -
Mise à jour 2019.Eur Urol.2019 ;76 : 639-57.
46. Aragon-Ching JB.Défis et progrès dans le diagnostic, la biologie et le traitement des carcinomes urothéliaux des voies supérieures et de la vessie.Urol Oncol.2017 ;35 : 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiocarcinome – évolution des concepts et stratégies thérapeutiques.Nat Rev Clin Oncol.2018 ;15 : 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Biopsie liquide en hépatocellulaire
carcinome : cellules tumorales circulantes et ADN tumoral circulant.Cancer de Mol.2019 ;18 : 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K et al.Pan-cancer
détection de l'ADN tumoral circulant chez plus de 10 000 patients chinois.Nat Commun.2021 ;12h11.
50. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R et al.Nouveaux critères d'évaluation de la réponse dans les tumeurs solides : ligne directrice RECIST révisée (version 1.1).Eur J Cancer.2009 ;45 : 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - apprendre du passé pour construire l'avenir.Nat Rev Clin Oncol.
2017 ;14 : 187-92.
52. Seymour L, Bogaerts J, Perrone A, Ford R, Schwartz LH, Mandrekar S et al.iRECIST : lignes directrices pour les critères de réponse à utiliser dans les essais
tester les immunothérapeutiques.Lancette Oncol.2017 ;18 : e143-52.
53. PantelK, Alix-Panabières C. Biopsie liquide et maladie résiduelle minime – dernières avancées et implications pour la guérison.Nat Rev Clin Oncol.2019 ;16 : 409-24.
Citer cet article comme suit : Qian C, Zou X, Li W, Li Y, Yu W. L'avant-poste contre le cancer : des marqueurs universels du cancer uniquement.Cancer Biol Med.2023 ;20 : 806-815.
est ce que je: 10.20892/j.issn.2095-3941.2023.0313
Heure de publication : 07 mai 2024